Дыхательная недостаточность у новорожденных
Содержание:
- Симптомы и стадии острой почечной недостаточности
- Почему при коронавирусе снижается сатурация?
- Методы диагностики ОПН
- Что означает КТ1, КТ2, КТ3, КТ4 при вирусной пневмонии COVID-19?
- Назначение:
- Лечение острой почечной недостаточности
- Текст подготовил
- Определение болезни. Причины заболевания
- Что делать, если упала сатурация?
- Диагностика низкого пульса
- Как поднять сатурацию после вирусной пневмонии?
- Классификация и стадии развития обструктивного бронхита у детей
- Выводы
- Сведения об авторах Улумбекова Гузель Эрнстовна – доктор медицинских наук, руководитель Высшей школы организации и управления здравоохранением (ВШОУЗ),
- Калашникова Александра Владимировна – научный сотрудник Научно-исследовательского центра по анализу деятельности системы здравоохранения Высшей школы организации и управления здравоохранением (ВШОУЗ)
- Мокляченко Алина Викторовна – кандидат технических наук, старший научный сотрудник Научно-исследовательского центра по анализу деятельности системы здравоохранения Высшей школы организации и управления здравоохранением (ВШОУЗ)
Симптомы и стадии острой почечной недостаточности
У 90% мужчин и женщин почечная недостаточность имеет типичное течение с последовательной сменой 4 фаз:
- начальная;
- олигоанурическая;
- фаза полиурии (восстановления диуреза);
- период выздоровления.
На начальной стадии специфические признаки отсутствуют, поэтому диагностика затруднена. Пациенты могут ощущать слабость, сонливость, тошноту, но часто эти симптомы игнорируются либо остаются незамеченными на фоне более острых проявлений основного заболевания. При МКБ на первый план выходят признаки почечной колики, при интоксикациях человека больше беспокоят расстройства ЖКТ, а при шоковых состояниях клиническая картина развивается так быстро, что период предвестников теряется.
Главный симптом второй стадии ОПН — уменьшение выделения мочи менее 500 мл в сутки. При этом в крови накапливается большое количество продуктов метаболизма и изменяется содержание микроэлементов. Кожа и слизистые оболочки пациента становятся сухими, пульс ускоряется, артериальное давление снижается. Нередко возникают боли и судороги в мышцах, затруднения дыхания, спазм гортани, кишечная непроходимость. Больной находится в состоянии угнетенного сознания, тяжесть психических нарушений определяется причиной дисфункции почек. Вторая фаза почечной недостаточности продолжается от нескольких дней до 4-6 недель, хотя продолжительная олигурия более характерна для пожилых мужчин и женщин с множественными сопутствующими заболеваниями.
При успешном лечении, когда острая недостаточность почек переходит в третью фазу развития, у пациентов постепенно увеличивается диурез. Количество суточной мочи превышает 2-2,5 л, она имеет небольшую плотность. Длительность симптомов полиурии составляет до 2 недель, а у женщин с акушерской патологией эта фаза может немного удлиняться из-за медленного восстановления работы почек.
Почему при коронавирусе снижается сатурация?
Не у всех пациентов при COVID-19 снижается сатурация, а только при развитии осложнения — вирусной пневмонии. Снижение сатурации говорит о вероятной дыхательной недостаточности. Если коронавирусная инфекция проникла к легочной ткани, а иммунитет человека не может справиться с ней, в легких начинается деструктивный процесс — альвеолярные перегородки (и интерстиций) повреждаются и воспаляются, а сами альвеолы заполняются жидким экссудатом — в норме они заполнены воздухом и являются начальным пунктом транспортировки кислорода к органа, в том числе к сердцу и головному мозгу. Поскольку при коронавирусе повреждение бронхиального дерева не наблюдается, снижение сатурации у пациента может говорить о сокращении функциональных участков легочной ткани.
Если при коронавирусе сатурация ниже 95%, больного могут госпитализировать.
Методы диагностики ОПН
Острая почечная дисфункция диагностируется без труда благодаря ярким симптомам олигоанурической стадии. Грамотный врач определяет ее уже при первичном осмотре пациента, а дополнительные исследования назначаются для уточнения тяжести нарушений здоровья.
При первичной диагностике врач обращает внимание на такие признаки:
- состояние водного баланса по степени упругости и гидратации кожного покрова и слизистых оболочек;
- наличие геморрагических или других высыпаний на коже;
- состояние нервной системы по степени сохранности рефлексов, уровню сознания, внешнему виду глазного дна;
- работу сердечно-сосудистой системы по данным измерения АД, подсчета пульса, перкуссии и аускультации сердца;
- состояние органов брюшной полости, в том числе возможность острой хирургической или акушерско-гинекологической (у женщин) патологии.
Недостаточность почечной функции подтверждают данными лабораторной диагностики. Основной метод — биохимический анализ крови с определением показателей общего белка, креатинина, мочевины, калия, натрия, кальция, фосфора. Для подбора правильного лечения может потребоваться расширенное обследование:
- общий анализ мочи (при наличии мочевыделения);
- биохимический анализ мочи;
- общий анализ крови;
- показатели свертывающей системы крови;
- иммунологические тесты на уровень комплемента, ревматоидного фактора, антинуклеарных антител — если почечная недостаточность предположительно вызвана нефрологическим заболеванием;
- УЗИ почек, мочеточников и мочевого пузыря;
- КТ забрюшинного пространства и органов малого таза.
Для упрощения диагностики организация KDIGO в 2012 году предложила использовать 3 основных симптома:
- увеличение уровня креатинина в сыворотке крови на о,3 мг/до и более за 48 часов;
- повышение креатинина в крови более чем в 1,5 раза от исходного уровня за последние 7 дней;
- показатель диуреза менее 0,5 мл/кг/час в течении 6 и более часов.
Что означает КТ1, КТ2, КТ3, КТ4 при вирусной пневмонии COVID-19?
Чтобы врачи могли объективно оценивать объем поражения легких, взвешивать риски и реагировать на вызовы, был принят единый стандарт классификации вирусных пневмоний по степени тяжести, где:
КТ-0 — отсутствие признаков вирусной пневмонии;
КТ-1 — легкая форма пневмонии с участками «матового стекла», выраженность патологических изменений менее 25%;
КТ-2 — умеренная пневмония, поражено 25-50% легких;
КТ-3 — среднетяжелая пневмония, поражено 50-75% легких;
КТ-4 — тяжелая форма пневмонии, поражено >75% легких.
Процент деструкции легочной ткани определяется по томограммам. Врач-рентгенолог оценивает по пятибалльной шкале каждую из пяти долей легких.* Если признаки пневмонии не выявлены, то значение соответствует 0; 1 балл свидетельствует о поражении легких 5%, и так далее.
* Согласно «Временным методическим рекомендациям» Министерства Здравоохранения РФ от октября 2020 г., принятая и описанная выше балльная система оценки легочных сегментов и долей упразднена. Объективность оценки поддерживается программным обеспечением и медицинской экспертизой.
Иными словами, сокращение КТ1, КТ2, КТ3 или КТ4, которое врач-рентгенолог пишет в заключении, указывает на объемы нефункциональной легочной ткани в совокупности с другими признаками, характерными для той или иной стадии. Это эмпирическая визуальная шкала, принятая рентгенологами.
Данную шкалу визуальной оценки легких по результатам компьютерной томографии (или МСКТ) разработали только во время пандемии новой коронавирусной инфекции. Ее ввели специалисты из Центра диагностики и телемедицины США, изучив КТ-исследования 13 003 человек, которые составили основную выборку.
Примечательно, что скорость перехода пневмонии к следующей, более осложненной степени зависит не только от возраста пациента (чем старше, тем быстрее), но и от текущей стадии заболевания. А именно, если вирусная пневмония SARS-CoV-2 у пациента была выявлена еще на первой стадии (КТ1), то предотвратить переход к следующей (КТ2) будет легче как минимум потому, что сравнительно малому числу вирионов требуется больше времени, чтобы распространиться по легким и спровоцировать более обширный воспалительный процесс. В то время как переход от КТ3 к КТ4 происходит очень быстро, и тогда жизнь пациента находится под угрозой. Анализируя уже упомянутую группу пациентов, ученые из США пришли к выводу, что при переходе в следующую группу, риск летального исхода при коронавирусе увеличивался примерно на 38%.
Процент вовлечения паренхимы (собственно поражения) легких в заключениях обычно указан приблизительно, поэтому диапазон значений может быть довольно широким, однако это не главный показатель. При определении степени тяжести воспаления легких учитываются и другие признаки воспаления легких:
1) Наличие «матовых стекол» на сканах КТ, их локализация, консолидация. «Матовые стекла» — это светлые участки легких на томограммах, которые свидетельствуют об очагах инфильтрации. Плотная ткань не пропускает рентгеновские лучи. «Матовые стекла» — основной признак поражения легких на КТ. Их распространенность и консолидация соответствует тяжелым стадиям пневмонии КТ3 и КТ4.
2) Утолщение междолькового пространства легких или «симптом булыжной мостовой» — ткань легких на сканах КТ имеет внешнее визуальное сходство с брусчаткой. Соответствует тяжелой стадии пневмонии КТ4.
3) Симптом «обратного гало» или «ободка́» — на томограммах выглядит как светлые кольца. Это участки уплотнения вокруг очага инфекции. Считается признаком организующейся пневмонии.
4) Ретикулярные изменения — тонкие линии патологически измененного легочного интерстиция, формирующие сеть.
Если в заключении указана «полисегментарная пневмония», это значит, что признаки воспалительного процесса обнаружены в обоих легких, в нескольких сегментах.
Назначение:
1.Обеспечение компенсаторной функции почек, фильтрация крови от токсических соединений и конечных продуктов метаболизма. Гемодиализ при хронической недостаточности проводят трижды за неделю, но нарастание интоксикации – основание для более частого проведения процедуры. При крайне тяжести, диализ выполняют до конца жизни, или пока не трансплантируют здоровую почку. 2. Почечная недостаточность, как осложнение острого гломерулонефрита, пиелонефрита. Цель назначения процедуры – вывести излишек жидкости из организма, устранить отеки, эвакуировать продукты токсического свойства. 3. Дисбаланс электролитов в крови. Указанное состояние происходит вследствие массивных ожогов, перитонита, обезвоживания, лихорадочных явлений. Гемодиализ позволяет вывести чрезмерную концентрацию ионов одного вида, заместив их другими. Также показанием для рассматриваемой процедуры выступает избыток жидкости в организме, что приводит к отеку оболочек головного мозга, сердца, легких. Диализ помогает сократить отечность и снизить уровень артериального давления. Процедура гемодиализа проводится на АИП с помощью одноразовых расходных материалов, к которым относятся диализаторы, кровопроводящие магистрали, фистульные иглы, катетеры, диализные концентраты.
Лечение острой почечной недостаточности
Острая почечная дисфункция требует неотложной помощи. Пациента госпитализируют в отделение реанимации и интенсивной терапии, где можно провести полноценное лечение. На стадии начальных признаков основной задачей врачей является устранение причины ОПН. С этой целью применяют:
- восполнение водно-электролитного баланса внутривенными инфузиями;
- промывание ЖКТ, применение энтеросорбентов и антидотов, если у пациента острая интоксикация;
- проведение гемосорбции или плазмафереза для быстрого удаления токсинов из крови;
- постановку трансуретрального катетера или экстренную операцию для удаления камней из мочевыводящих путей.
При снижении выделения мочи на втором этапе почечной недостаточности рекомендуется назначение диуретиков, которые борются с гипергидратацией организма. Чаще всего используют препараты из группы петлевых диуретиков, чтобы получить быстрый эффект. По показаниям проводится антикоагулянтная и антиагрегантная терапия, чтобы улучшить кровоснабжение почек. Симптоматическое лечение может включить витаминно-минеральные комплексы, применение гастропротекторов, адекватное обезболивание, назначение противорвотной терапии.
После ликвидации признаков острой недостаточности почек пациентам назначается диспансеризация у нефролога или уролога для контроля работы почек и основных показателей крови. Особенно это касается больных с длительным периодом олигоанурии, при котором со временем может сформироваться хроническая почечная недостаточность. Пристальному наблюдению подлежат люди с сопутствующей патологией, например, при мочекаменной болезни или при аденоме простаты у мужчин.
Текст подготовил
Котов Максим Анатольевич, главный врач центра КТ «Ами», кандидат медицинских наук, доцент. Стаж 19 лет
Список источников
- Котов М.А. Опыт применения компьютерной томографии в диагностике заболеваний органов дыхания у детей / Материалы X Невского радиологического Форума (НРФ-2018). – СПб., 2018, Лучевая диагностика и терапия. 2018. № 1 (9). — С. 149.
- Панов А.А. Пневмония: классификация, этиология, клиника, диагностика, лечение, 2020.
- Бова А.А. Пневмонии: этиология, патогенез, клиника, диагностика, 2016.
- Chl Hong, M.M Aung , K. Kanagasabai , C.A. Lim , S. Liang , K.S Tan. The association between oral health status and respiratory pathogen colonization with pneumonia risk in institutionalized adults, 2018.
- Yang-Pei Chang, Chih-Jen Yang, Kai-Fang Hu, A-Ching Chao, Yu-Han Chang, Kun-Pin Hsieh, Jui-Hsiu Tsai, Pei-Shan Ho, Shen-Yang Lim. Risk factors for pneumonia among patients with Parkinson’s disease: a Taiwan nationwide population-based study, 2016.
- Клинические рекомендации по диагностике, лечению и профилактике тяжелой внебольничной пневмонии у взрослых. Министерство здравоохранения РФ, 2019.
Определение болезни. Причины заболевания
Обструктивный бронхит — это воспаление бронхов, которое сопровождается сужением их просвета (обструкцией), бронхоспазмом и нарушением проходимости воздуха. Проявляется одиночным, но достаточно частым кашлем, шумным, затруднённым дыханием и свистящими звуками на выдохе.
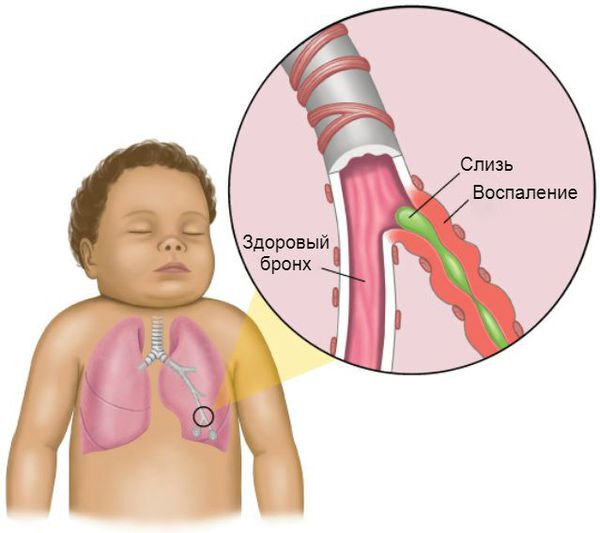
С обструктивным бронхитом сталкиваются дети любого возраста. В основном он возникает в период, начиная с 6 месяцев до 5 лет. Ему подвержены дети с ослабленным иммунитетом, аллергией, генетической предрасположенностью, повторными и затяжными ОРВИ.
Число заболеваний, протекающих с синдромом бронхообструкции, неуклонно растёт, хотя причины этого пока неясны. В России заболеваемость обструктивным бронхитом составляет 75-250 случаев на 1000 детей 1-3 лет, что на 2 порядка выше, чем при пневмонии. В амбулаторной практике США распространённость заболевания оценивается в 60-70 случаев на 1000 детей 0-2 лет, однако к 4-м годам и старше этот показатель резко снижается до 35 случаев на 1000 детей.
Чаще всего обструктивный бронхит развивается в ответ на респираторные вирусы, особенно на респираторно-синцитиальный вирус. Он является причиной болезни у 85 % детей до 6 месяцев и 28 % детей постарше. Реже заболевание вызывают другие респираторные инфекции:
- риновирусы — у недоношенных детей (особенно с бронхолёгочной дисплазией и находящихся на искусственном вскармливании);
- вирусы парагриппа 3-го типа — у детей 1-3 лет;
- аденовирусы — у детей 4-6 лет;
- вирусы парагриппа;
- энтеровирусы.
В последние 10-15 лет среди причин обструктивных форм бронхита часто регистрируют вирусы герпеса: цитомегаловирус, вирус Эпштейна — Барр и вирус герпеса 6-го типа. Также обструктивный бронхит нередко провоцируют грибковые инфекции, особенно если ребёнок регулярно находится в помещении с повышенной влажностью.
В преддошкольном и школьном возрасте заболевание могут вызвать бактерии: патогенные бактерии (микоплазмы и хламидии пневмонии), а также условно-патогенная флора, которая входит в состав нормальной микрофлоры дыхательных путей.
Нередко в развитии заболевания принимают участие сразу несколько вирусов, т. е. микст-инфекции. Они часто становятся хроническими, являясь главной причиной повторных ОРЗ.
Рецидивы обструктивного бронхита обычно возникают на фоне глистной инвазии или хронической инфекции — тонзиллита, кариеса, синусита и др.
Развитию обструктивного бронхита могут предрасполагать факторы риска:
- Отягощённое течение беременности и родов, недоношенность младенца, внутриутробное инфицирование плода, поражение центральной нервной системы на последних неделях беременности, во время или после родов, раннее искусственное вскармливание, дистрофии.
- Особенности, свойственные детям до 3 лет: незрелость иммунной системы, обильное кровоснабжение лёгочной ткани, повышенная проницаемость сосудов, малый диаметр и рыхлость подслизистого слоя бронхов, повышенная податливость их хрящей, вязкость бронхиального секрета, недоразвитие гладкомышечной и эластической ткани.
- Долгое пребывание малыша в горизонтальном положении, более длительный сон, частый плач.
- Употребление алкоголя, пассивное и активное курение во время беременности или кормления — всё это подавляет иммунитет младенца, тормозит созревание и развитие его центральной нервной системы.
- Неблагоприятные факторы внешней среды: воздействие аммиака, хлора, сернокислого газа, окиси углерода, различных кислот, угольной и цементной пыли.
- Частые переохлаждения из-за чрезмерно низкой температуры воздуха в районах крайнего Севера, повышенная влажность и другие факторы, связанные с климатом и географией.
- Аллергический фактор: повышенная чувствительность к продуктам, домашней пыли и шерсти животных. В таких случаях обструктивному бронхиту может сопутствовать аллергический дерматит, ринит и/или конъюнктивит.
Что делать, если упала сатурация?
Не паникуйте из-за снижения сатурации — нормальные жизненные показатели можно быстро восстановить, и даже значение 70% в течение нескольких дней совместимо с жизнью, причем шансы могут быть даже выше, если у пациента, например, хроническая обструктивная болезнь легких, и к низкому уровню кислорода его организм уже адаптировался. Сатурация может падать несколько дней.
Тем не менее, если при коронавирусе сатурация упала до 95%, 93, 90…%, а все измерения произведены верно (важно проверить, чтобы у пульсоксиметра был адекватный уровень заряда батареи, а сам прибор был зарегистрирован как медицинское изделие, а не приобретен у сомнительного производителя) — необходимо вызвать скорую помощь
Диагностика низкого пульса
Определение причин патологически низкого пульса предусматривает проведение комплексной диагностики. Прежде всего врач выслушивает жалобы пациента, собирает анамнез и проводит осмотр. При выявлении брадикардии (т. е. снижения пульса) пациенту назначают . Что касается диагностических исследований, то они заключаются в следующем:
- Электрокардиография;
- Суточный мониторинг по Холтеру;
- УЗ-сканирование сердца;
- ;
- Велоэргометрия.
Помимо этого, при необходимости, может быть проведено ЧПЭФИ, которое позволяет изучить проводящие пути сердца и определить органический или функциональный характер заболевания.
Как поднять сатурацию после вирусной пневмонии?
Если и после перенесенного коронавируса сатурация немного снижена, то это нормально — легочной ткани требуется время на восстановление прежней жизненной емкости дыхательного органа. Крайне полезны дыхательная гимнастика (см. комплекс дыхательных упражнений Стрельниковой) и прогулки на свежем воздухе с умеренными физическими нагрузками.
Для предотвращения агрессивного спаечного процесса в легких пациентам с выраженными на КТ фиброзными изменениями; обычно при КТ-4, КТ-3, реже при КТ-2 и очень редко при КТ-1 назначается антиоксидантная терапия пневмофиброза, которая включает диету, обогащенную антиоксидантами, ацетилцистеин, витамины группы Е (если нет аллергии).
Для уточнения диагноза и причин сниженной сатурации, после коронавируса важен КТ-контроль.
Классификация и стадии развития обструктивного бронхита у детей
В отечественной литературе выделяют три формы обструктивного бронхита:
- бронхиолит;
- острый обструктивный бронхит;
- рецидивирующий обструктивный бронхит (при бронхолёгочной дисплазии, обструктивном бронхиолите и др.).
Все они отличаются и симптомами, и патогенетическими изменениями. Однако в зарубежной литературе обструктивный бронхит и бронхиолит часто описывают вместе, так как обе формы заболевания протекают с обструкцией бронхов.
Бронхиолит в основном возникает у детей до 2 лет в ответ на респираторно-синцитиальную инфекцию, реже — на риновирусы. Развивается постепенно на фоне поначалу нетяжёлой ОРВИ, но в дальнейшем переходит в более тяжёлую форму, приводя к дыхательной и сердечной недостаточности.
Для бронхиолита характерно обилие влажных мелкопузырчатых и трескучих хрипов как на вдохе, так и на выдохе, т. е. ярко выражена картина «влажного лёгкого». При нарастании выраженной одышки (увеличении числа дыхательных движений до 70-80 раз в минуту) дыхание становится поверхностным, влажных мелкопузырчатых и трескучих хрипов становится меньше. Слышен усиленный вдох, заметно раздуваются крылья носа, нарастают симптомы острой сердечной недостаточности: кашель, тахикардия, побледнение кожи, увеличение печени.
Острый обструктивный бронхит чаще возникает у детей 3-5 лет, хотя может встречаться и в более старшем возрасте. Его развитие связывают с вирусами парагриппа 3-го типа, аденовирусами, вирусами гриппа и атипичными возбудителями. Развивается как постепенно, так и более остро: с повышения температуры тела до 38-39 °С, насморка, заложенности носа и кашля. Постепенно нарастает дыхательная недостаточность с увеличением частотой дыхания до 40-60 раз в минуту. Ребёнку становится тяжелее дышать, поэтому организм подключает к этому процессу мышцы шеи и плеч. Появляются свистящие хрипы на выдохе.
Выдох затруднён и удлинён. При простукивании в проекции лёгких возникает звук, похожий на шум при поколачивании по пустой коробке. На выдохе чаще выслушиваются рассеянные сухие свистящие хрипы, на вдохе — влажные мелкопузырчатые, т. е. эффект «влажного лёгкого» при остром обструктивном бронхите можно не услышать.
Рецидивирующий обструктивный бронхит может возникать с первого года жизни и затем в любом возрасте. Развивается чаще в ответ на длительное нахождение в организме цитомегаловируса, вируса Эпштейна — Барр, вируса герпеса 6-го типа и микоплазмы. Реже он может быть связан с обычными респираторными вирусами. Нередко встречается сразу несколько причинных вирусов, особенно у часто и длительно болеющих детей.
Обструкция бронхов обычно развивается постепенно: на фоне нормальной или субфебрильной температуры (до 38 °С) с небольшой заложенностью носа, насморком и редким покашливанием. Одышка выражена незначительно, частота дыхания редко превышает 40 движений в минуту. Общее состояние ребёнка практически не страдает.
При простукивании отмечается лёгочный звук с лёгким коробочным оттенком. При выслушивании характерны рассеянные сухие свистящие хрипы на фоне подчёркнутого выдоха, влажные хрипы на вдохе необильные или вовсе отсутствуют.
По течению бронхообструктивного синдрома выделяют:
- острый бронхит — синдром присутствует до 10 дней;
- затяжной бронхит — синдром сохраняется от 10 дней и более;
- рецидивирующий бронхит — синдром повторяется 3-6 раз в год;
- непрерывно рецидивирующий бронхит — частота и тяжесть синдрома повторяются более 6 раз в год.
Выводы
1. В России с 1980 по 2015 г. показатель младенческой смертности снизился на 70%, перинатальной смертности – на 47%. Однако по сравнению с «новыми-8» странами ЕС в России коэффициент младенческой смертности в 1,6 раза выше, коэффициент перинатальной смертности – в 2,3 раза выше. Это говорит о наличии существенных резервов в улучшении данных показателей.
2. В России с 1990–1991 по 2015 г. показатели первичной заболеваемости детей и подростков резко возросли практически по всем классам болезней.
3. В структуре причин детской инвалидности (0–17 лет) преобладают психические расстройства (26%) и болезни нервной системы (24%). Эти причины являются предотвратимыми и управляемыми методами своевременной профилактики, лечения и реабилитации.
4. В России с 2000 по 2015 г. факторы, определяющие мощность педиатрической службы сократились: обеспеченность детского населения педиатрами – в 1,3 раза, педиатрическими койками – в 1,9 раза. С 2007 г. обеспеченность врачами-педиатрами участковыми сократилась на 13%. Сегодня их дефицит превысил 10 тыс. врачей от установленных нормативов
5. Для улучшения показателей здоровья детей и подростков необходимо предпринять меры по совершенствованию работы педиатрической службы – привести мощности педиатрической службы в соответствие с потребностями детского населения в профилактической и медицинской помощи.